Premières preuves scientifiques que les nanofilaments extracellulaires manipulent la forme des cellules
À première vue, elle a l'air d'une surface verte uniforme ; mais sous un microscope, une feuille ordinaire révèle une mosaïque complexe de cellules aux formes irrégulières, comme des pièces de puzzle parfaitement emboîtées. Chacune des cellules à la surface de cette feuille, appelées cellules épithéliales, a une forme unique et continue à s'élargir et à changer de forme pendant la croissance de la feuille.
Selon l'explication actuelle dans les livres de science, la pression hydrostatique (turgescence) à l'intérieur des cellules exercée contre la paroi cellulaire rigide autour de celles-ci leur donnerait leur forme finale ondulée si particulière. Les parties les plus faibles de cette paroi s'élargiraient davantage, tout comme la pression de l'air force les zones les plus faibles d'un ballon à se gonfler davantage.
Cette théorie a maintenant changé, car une équipe de scientifiques a démontré que la turgescence n'est pas nécessaire à la définition initiale de la forme de la cellule - ni même à sa croissance. Des chercheurs de l'équipe "Paroi primaire", de l'Université de Cambridge et de Caltech/de l’Institut médical Howard Hughes, ont découvert que la paroi cellulaire elle-même joue un rôle actif dans la définition de la forme des cellules végétales.
Les résultats de l'"équipe" incluent l'identification de nouvelles structures à l'intérieur de la paroi cellulaire appelées nanofilaments de pectine : ces nanofilaments 1 000 fois plus fins qu'un cheveu humain influencent la forme des cellules indépendamment de la turgescence. Ces résultats ont aussi des implications pour le monde animal et pourraient inspirer le développement de matériaux intelligents à l'avenir.
Avant la découverte de l'"équipe", la pectine était perçue comme un liquide de remplissage, gélatineux et désorganisé, disposé entre les longues fibres de cellulose dans la paroi cellulaire. Selon le Dr Kalina T. Haas, auteure principale de la publication : « La biochimie est typiquement utilisée pour étudier les composants de la paroi cellulaire, mais étant donné qu'une analyse biochimique désintègre la paroi cellulaire afin d'en extraire les molécules pour un examen plus approfondi, nous n'avons pas la chance d'examiner la structure d'origine. Les microscopes à fluorescence ordinaires d'une résolution de 200 nm ne sont d'aucune utilité non plus, car la paroi cellulaire mesure seulement de 50 à 100 nm d'épaisseur et est donc trop petite pour en examiner la structure en détails. Pour surmonter ces obstacles, nous avons utilisé deux types de microscopie de pointe, dSTORM et cryoSEM, qui nous ont permis de maintenir la paroi cellulaire intacte. Ensemble, ces microscopes ont révélé que les pectines ne forment pas une « gelée » mais créent plutôt une colonnade (succession de colonnes) bien organisée, de dimensions nanométriques, le long du bord de la paroi cellulaire. »
Le cryo microscope à balayage (cryoSEM, très basse température) développé au laboratoire Sainsbury à l'Université de Cambridge a capturé les toutes premières images de ces filaments de pectine. Le Dr. Raymond Wightman, responsable du service d'imagerie au laboratoire Sainsbury, déclare : « C'était dans un laboratoire, il y a 40 ans, que des chimistes ont démontré pour la première fois que la pectine pourrait former des filaments, mais ceux-ci n'avaient jamais été observés dans la nature. Le cryoSEM nous a fourni les toutes premières images de pectine en tant que structures filamenteuses, et le microscope optique à très haute résolution appelé dSTORM a confirmé que nous observions bel et bien des structures de pectine. Ces résultats n'auraient pas pu être confirmés par un seul microscope. »
Le Dr. Kalina T. Haas et le Dr. Alexis Peaucelle d'INRAE ont adapté le microscope dSTORM du MRC/LMB afin d'analyser les cellules d'une feuille d'Arabidopsis thaliana (arabette des dames) à haute résolution, 20-40 nm. Ils ont découvert qu'un seul type de changement chimique (perte du groupement méthyle) dans des nanofilaments de pectine entraîne un gonflement des filaments et produit une expansion radiale de ceux-ci d'environ 40 %. Ce gonflement cause le fléchissement de la paroi cellulaire, ce qui entraîne la croissance et la formation de cellules ondulées aux formes particulières.
Le Dr. Peaucelle explique : « Ceci est lié à un changement dans l'organisation des polymères de pectine à l'intérieur du nanofilament, d'un treillis serré à un treillis plus lâche. Une telle auto-expansion des composantes de la paroi cellulaire, en combinaison avec leur orientation locale, peut mener à l'émergence de formes complexes. À l'aide d'un modèle informatisé, nous avons observé que le petit changement de taille causé par un nanofilament modifié suffit à créer la forme de pièce de puzzle de la cellule. De plus, ces changements de formes n'avaient pas besoin du stress de la turgescence présente à l'intérieur des cellules modélisées. »
Des recherches plus approfondies seront nécessaires pour déterminer le rôle joué par la turgescence et la cellulose de la paroi cellulaire dans la définition de la forme des cellules. Selon l'équipe, il est probable que la turgescence et la cellulose œuvrent aux côtés des nanofilaments de pectine pour contribuer à maintenir cette forme.
Le Dr. Peaucelle reprend : « Nous avons aussi remarqué que les formes de pièces de puzzle des cellules épithéliales des plantes étaient très bien ordonnées. Lorsque nous avons sonifié les images, nous avons observé que les formes étaient organisées en ondes semblables à celles produites par un instrument de musique. À titre d'exemple, nous avons utilisé différentes cellules pour créer les notes d'une gamme chromatique, puis s'en servir pour jouer ‘Le Beau Danube bleu’ de J. Strauss. De manière extraordinaire, en améliorant notre compréhension de la façon dont les cellules épithéliales forment leurs motifs ondulés, nous avons également confirmé que la pectine joue un rôle dans le processus de croissance. Cela souligne le peu de connaissances que nous avons sur quelque chose d'aussi vital pour la pérennité de notre société que la croissance des plantes. J'imagine que de nouvelles découvertes surviendront en matière de santé humaine et végétale à mesure que davantage d'attention sera portée sur la matrice extracellulaire autour des cellules, grâce à la nouvelle génération de microscopes à haute résolution. Bien que les cellules animales ne soient pas entourées de parois cellulaires, elles sont entourées d'une matrice extracellulaire de protéines et de sucres qui pourrait, elle aussi, influencer la forme de ces cellules. »
Le Dr. Haas conclut : « Les connaissances sur la structure de la paroi cellulaire sont essentielles pour comprendre comment les plantes prennent leurs formes complexes. Elles contribuent également au progrès des connaissances dans de nombreux domaines susceptibles de bénéficier à la société, par exemple l'immunité végétale, les biocarburants, l’agriculture, l'adaptation des plantes aux changements environnementaux et même le développement futur de matériaux intelligents auto-extensibles. »
Retour
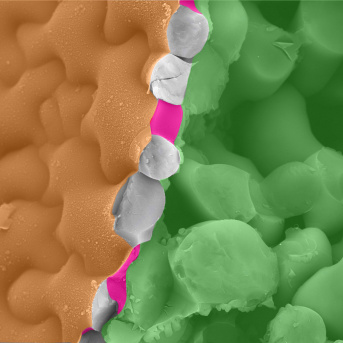
Arabidopsis : tissus de cotyledon en fausses couleurs, acquisition via un cryo (très basse température) microscope à balayage (cryoSEM). En utilisant des échantillons rapidement congelés, le cryoSEM conserve des contraintes naturelle des tissus et empèche la distorsion des échantillons. La fracture expose la paroi anticlinale (magenta) de la couche cellulaire de l'épiderme de la couche interne (vert).
Contact scientifique :
Alexis Peaucelle
Institut Jean-Pierre Bourgin (INRAE, AgroParisTech)
Département scientifique associé : BAP
Centre associé :
Ile-de-France - Versailles-Grignon
Référence :
Kalina T. Haas, Raymond Wightman, Elliot M. Meyerowitz et Alexis Peaucelle (2020) Pectin homogalacturonan nanofilament expansion drives morphogenesis in plant epidermal cells, Science, Vol. 367, Issue 6481, pp. 1003-1007
DOI: 10.1126/science.aaz510
Plus d'information :
Communiqué de presse INRAE
Video: Pectin homogalacturonan nanofilament expansion drives morphogenesis in plant epidermal cells.