Identification in planta d’oligosaccharides
Nous avons développé une méthode de chromatographie d’exclusion stérique couplée à un spectromètre de masse haute résolution afin d’identifier in planta les oligosaccharides présents dans diverses espèces végétales telles qu’Arabidopsis thaliana, la tomate et le blé et de différents organes tels que les graines, les hypocotyles étiolés, les feuilles ou les racines. Notre base de données contient actuellement plus de 1000 oligosaccharides.
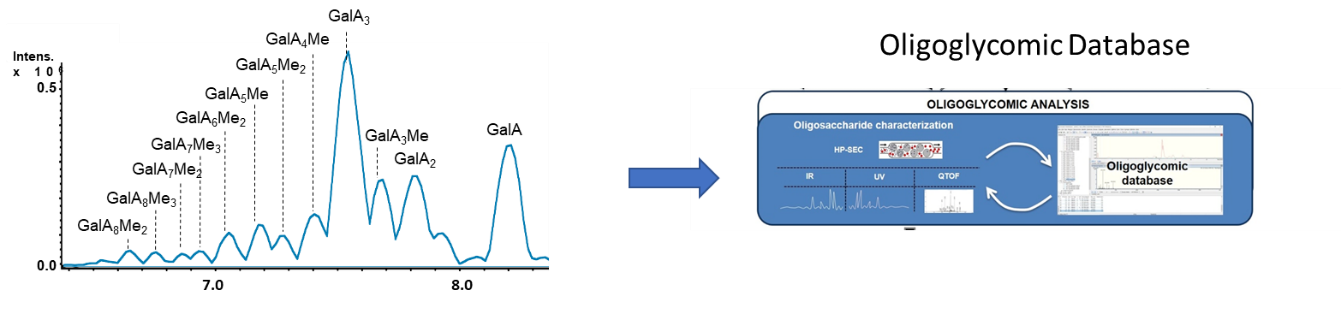
Exploration de la diversité des oligosaccharides
Les pectines qui représentent un des polysaccharides majeurs de la paroi végétale sont majoritairement formées d’homogalacturonanes qui peuvent être méthylés et acétylés. Les oligosaccharides qui en sont dérivés sont donc de taille (caractérisée par leur degré de polymérisation) et de structure (degré de méthylation et d’acétylation notamment) variables qui conditionnent leur activité « stimulateurs de défense des plantes » (SDP). Nous avons récemment montré que lors de l’interaction entre Arabidopsis thaliana et Botrytis cinerea, la collection d’oligosaccharides produits (oligoglycome) est essentiellement produite via l’action d’une pectine lyase (PNL) d’origine fongique qui clive les homogalacturonanes par β-élimination (Voxeur et al., 2019). Nous avons également montré qu’il existe d’autres types d’oligosaccharides qui sont issus par exemple du clivage d’autres polysaccharides comme le xyloglucane suggérant qu’il existe une très large diversité d’oligosaccharides (Voxeur et al., 2021).
Rôle biologique de divers métabolites secondaires et herbicides
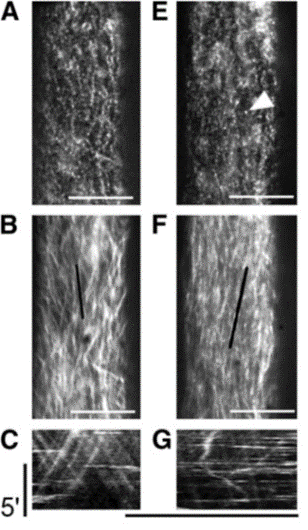
Nous explorons la diversité des métabolites et leur fonctions biologiques en tentant de les purifier (ou de les produire) et d’analyser leurs effets biologiques. Nous avons montré qu’une fraction semi-purifiée enrichie en GalA4MeAc-H2O permet d’activer les mécanismes de défense de la plante face à une attaque par Botrytis cinerea. Nous étudions également le rôle de certains métabolites fongiques et d’herbicides notamment sur la réorganisation pariétale en lien avec les microtubules corticaux. Nous visualisons par exemple en temps réel l’impact de ces molécules sur la biosynthèse de la cellulose et la dynamique des microtubules. Nous observons par exemple le déplacement des sous-unités catalytiques de cellulose synthase en conditions contrôle (A-C) ou en présence d’herbicides tels que le CGA 325'615 qui induit une internalisation des complexes constitués de sous-unités catalytiques de cellulose synthase dans des compartiments intracellulaires (E-G) (Crowell et al., 2009). Une partie de ces complexes sont présents au niveau des microtubules corticaux et présentent des déplacements très spécifiques.
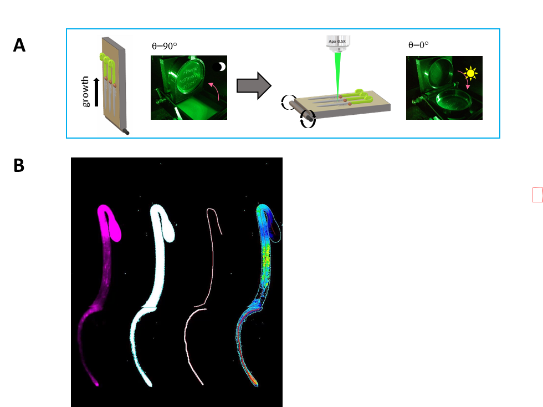
Visualisation de la croissance des plantes en temps réel à la verticale
Nous avons récemment développé un outil que nous avons nommé la VIP-box, permettant de faire de l’imagerie fonctionnelle automatisée d’une quinzaine de plantules entières et en croissance (A). Les plantules poussent sur un milieu solide et à la verticale, puis à chaque intervalle de temps prédéfini, le système bascule, plaçant les plantules à l’horizontale et permet l’acquisition d’une séquence d’images. L’outil ainsi développé permet de relier des processus physiologiques quantifiables par imagerie de fluorescence (expression d’un gène ou d’un biosenseur de pH(B), Ca2+, ROS, hormones…) aux mécanismes de croissance le long de la plantule (croissance apicale ou diffuse) (S. Vernhettes, F. Miart, DIRV_2018).
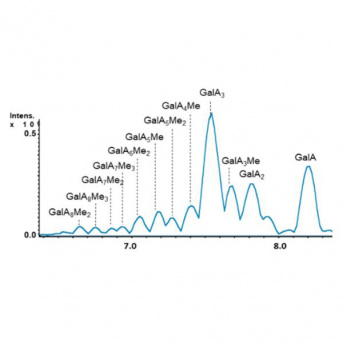
Nous avons développé une méthode de chromatographie d’exclusion stérique couplée à un spectromètre de masse haute résolution afin d’identifier in planta les oligosaccharides présents dans diverses espèces végétales telles qu’Arabidopsis thaliana, la tomate et le blé et de différents organes tels que les graines, les hypocotyles étiolés, les feuilles ou les racines. Notre base de données contient actuellement plus de 1000 oligosaccharides.

Exploration de la diversité des oligosaccharides
Les pectines qui représentent un des polysaccharides majeurs de la paroi végétale sont majoritairement formées d’homogalacturonanes qui peuvent être méthylés et acétylés. Les oligosaccharides qui en sont dérivés sont donc de taille (caractérisée par leur degré de polymérisation) et de structure (degré de méthylation et d’acétylation notamment) variables qui conditionnent leur activité « stimulateurs de défense des plantes » (SDP). Nous avons récemment montré que lors de l’interaction entre Arabidopsis thaliana et Botrytis cinerea, la collection d’oligosaccharides produits (oligoglycome) est essentiellement produite via l’action d’une pectine lyase (PNL) d’origine fongique qui clive les homogalacturonanes par β-élimination (Voxeur et al., 2019). Nous avons également montré qu’il existe d’autres types d’oligosaccharides qui sont issus par exemple du clivage d’autres polysaccharides comme le xyloglucane suggérant qu’il existe une très large diversité d’oligosaccharides (Voxeur et al., 2021).
Rôle biologique de divers métabolites secondaires et herbicides
Nous explorons la diversité des métabolites et leur fonctions biologiques en tentant de les purifier (ou de les produire) et d’analyser leurs effets biologiques. Nous avons montré qu’une fraction semi-purifiée enrichie en GalA4MeAc-H2O permet d’activer les mécanismes de défense de la plante face à une attaque par Botrytis cinerea. Nous étudions également le rôle de certains métabolites fongiques et d’herbicides notamment sur la réorganisation pariétale en lien avec les microtubules corticaux. Nous visualisons par exemple en temps réel l’impact de ces molécules sur la biosynthèse de la cellulose et la dynamique des microtubules. Nous observons par exemple le déplacement des sous-unités catalytiques de cellulose synthase en conditions contrôle (A-C) ou en présence d’herbicides tels que le CGA 325'615 qui induit une internalisation des complexes constitués de sous-unités catalytiques de cellulose synthase dans des compartiments intracellulaires (E-G) (Crowell et al., 2009). Une partie de ces complexes sont présents au niveau des microtubules corticaux et présentent des déplacements très spécifiques.

Visualisation de la croissance des plantes en temps réel à la verticale
Nous avons récemment développé un outil que nous avons nommé la VIP-box, permettant de faire de l’imagerie fonctionnelle automatisée d’une quinzaine de plantules entières et en croissance (A). Les plantules poussent sur un milieu solide et à la verticale, puis à chaque intervalle de temps prédéfini, le système bascule, plaçant les plantules à l’horizontale et permet l’acquisition d’une séquence d’images. L’outil ainsi développé permet de relier des processus physiologiques quantifiables par imagerie de fluorescence (expression d’un gène ou d’un biosenseur de pH(B), Ca2+, ROS, hormones…) aux mécanismes de croissance le long de la plantule (croissance apicale ou diffuse) (S. Vernhettes, F. Miart, DIRV_2018).

Responsable :
Samantha Vernhettes