Bienvenue sur la page Web de l'équipe SYNAPS !

Objectifs scientifiques :
L'objectif du programme de recherche est d'améliorer ou maintenir la productivité des plantes lorsque la fertilisation azotée est réduite. Pour ce faire, nous exploitons l'impact bénéfique de l'environnement microbien dans la rhizosphère et la diversité génétique existante ou créée de plantes cultivées en ce qui concerne l'absorption et l’assimilation de l'azote. (Figure 1).
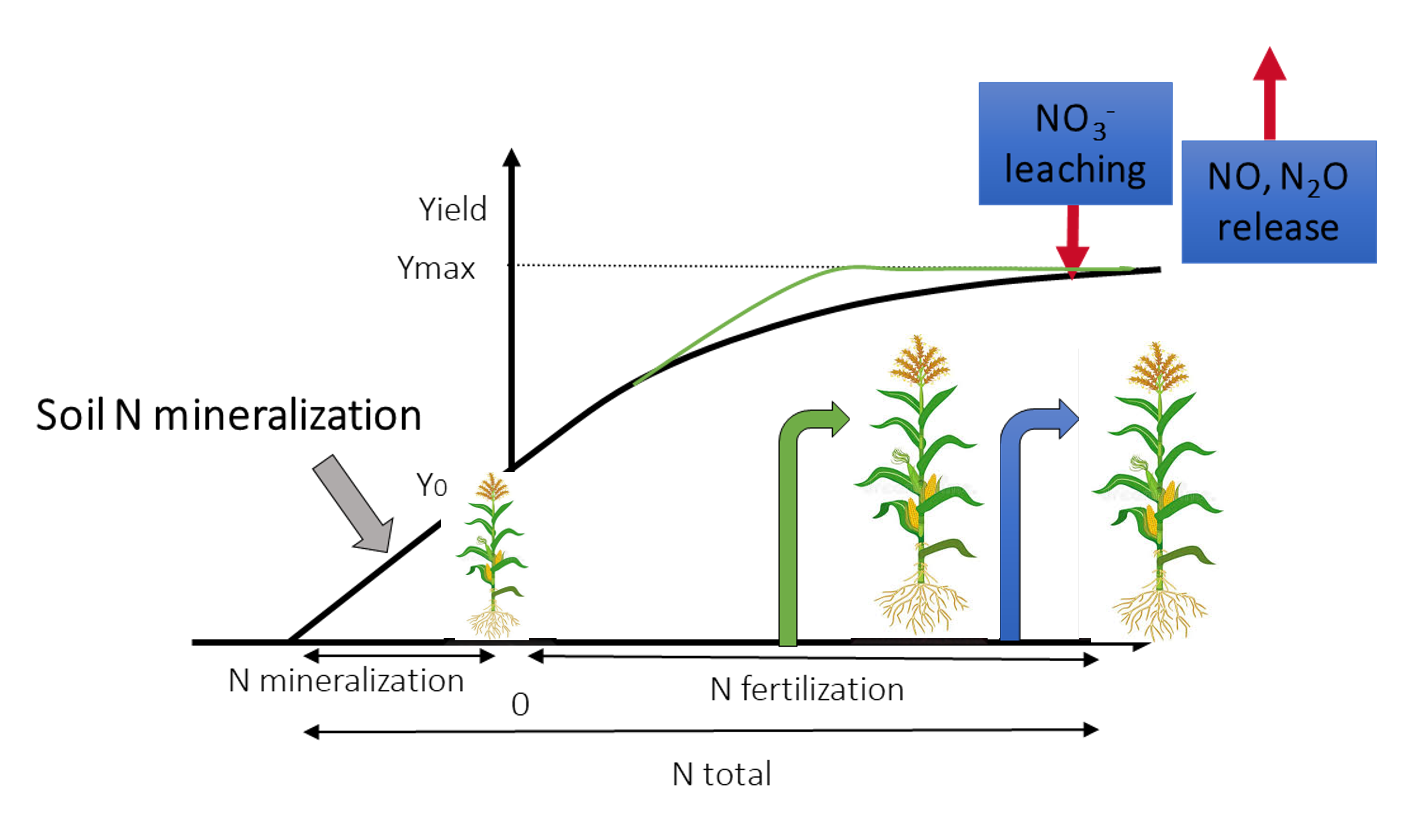
Figure 1: L'efficacité d'utilisation de l'azote (NUE) permet de déterminer la capacité d'une plante cultivée à gérer l'azote disponible pour produire des rendements en grains ou en biomasse. La plante avec la flèche verte présente une meilleure NUE que celle avec la flèche bleue. Une NUE plus élevée entraîne une moindre utilisation d'engrais et un impact environnemental moindre.
Nos questions biologiques :-
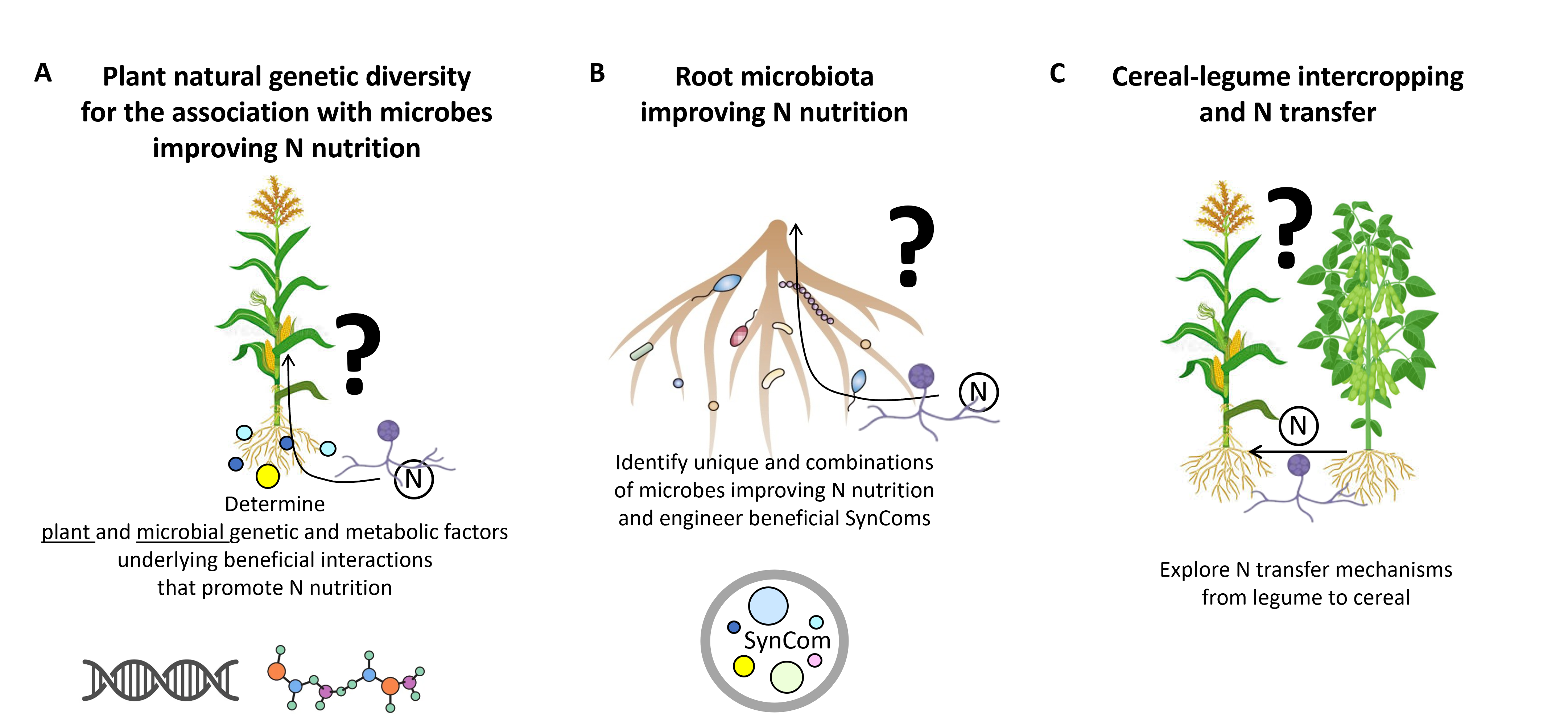
A) Quels sont les mécanismes physiologiques, métaboliques et moléculaires impliqués dans la nutrition azotée du maïs lors de la symbiose avec les CMA? Nous avons démontré que l'interaction du maïs avec le champignon mycorhizien à arbuscules (CMA) Rhizophagus irregularis atténue le stress dû à la carence en azote du maïs (Figure 3) et développons une série d'outils biologiques et expérimentaux pour comprendre par quels mécanismes ce processus a lieu (Collaboration avec D. WIPF et P-E. COURTY INRAE Dijon). Nous développons et intégrons des approches multi-omiques, incluant des données transcriptomiques, métabolomiques, fluxomiques et ionomiques au niveau des organes végétaux et incluant les compartiments microbiens. En utilisant la microscopie, nous suivons le devenir des arbuscules pendant la symbiose (Figure 4) en essayant de déterminer si leur décomposition peut fournir de l'azote à la plante. Ces approches nous aideront à mieux comprendre les processus physiologiques et moléculaires sous-jacents aux interactions maïs-microbiote qui améliorent l'efficacité de l'utilisation de l'azote du maïs.
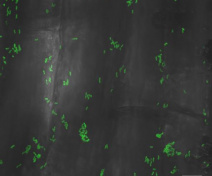
 Figure 3: Plantes de maïs cultivées sous N limitant et inoculées avec le CMA R. irregularis (à droite) ou non (à gauche).
Figure 3: Plantes de maïs cultivées sous N limitant et inoculées avec le CMA R. irregularis (à droite) ou non (à gauche).Nous avons mis en œuvre des approches de biologie des systèmes basées sur des outils d'analyse multi-omique et de modélisation métabolique. Grâce à une collaboration avec le Dr Rajib SAHA (Univ. Nebraska), notre étude soutient l'idée que la voie métabolique des pyrimidines est un élément crucial du métabolisme de l'azote du maïs pendant la symbiose dans des conditions limitées en azote (Decouard et al., 2023, BioRxiv, Chowdhury et al. 2023). En collaboration avec l'équipe NUTS de l'IJPB, nous étudions la réponse de Brachypodium distachyon à R. irregularis dans des conditions de faible teneur en N. En collaboration avec l'équipe QALIBIOSEC de l'IJPB, nous étudions le rôle des parois cellulaires végétales dans la symbiose AM et vice versa.
.
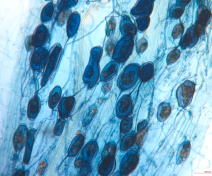
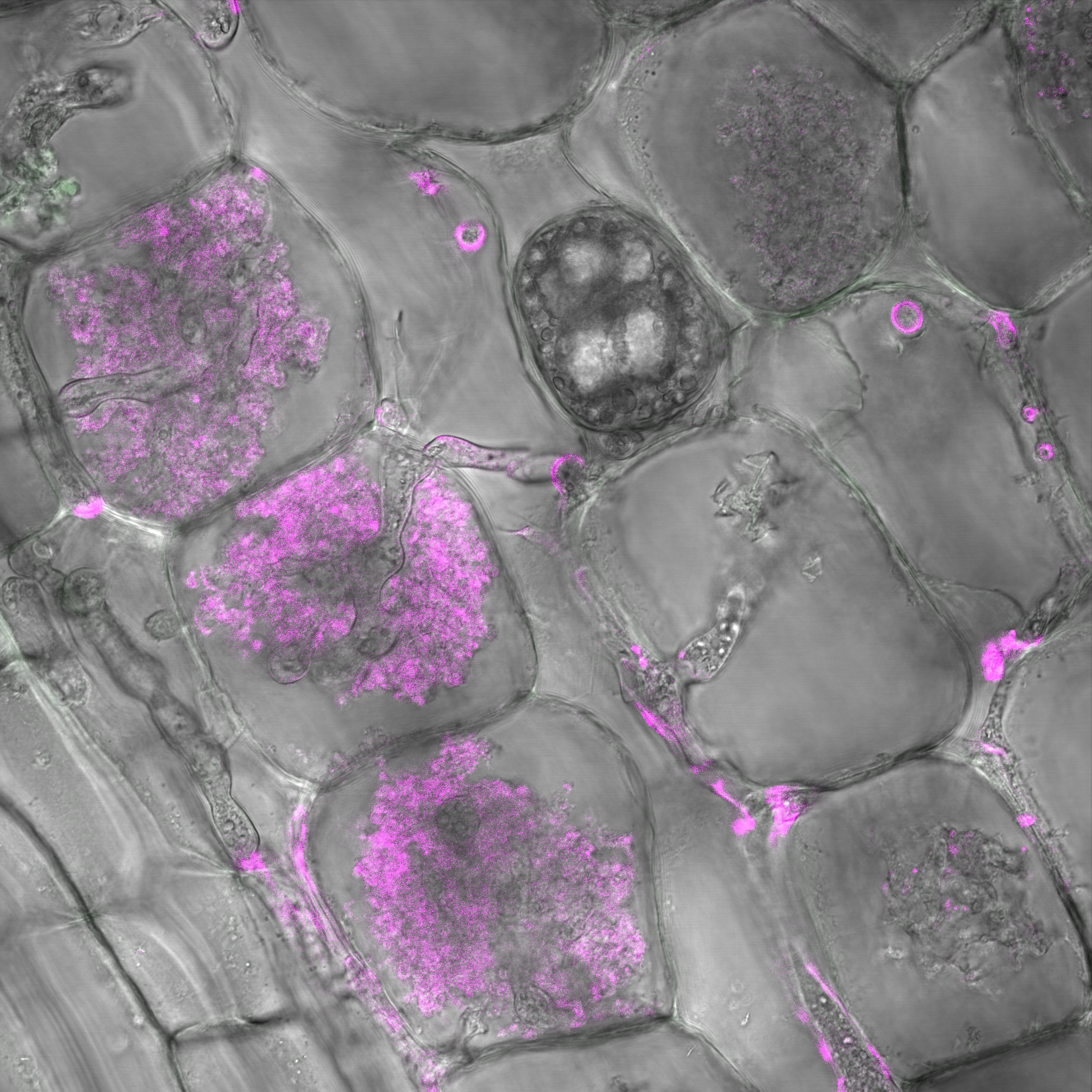 Figure 4: Racines de maïs colonisées par des arbuscules colorées au "wheat germ agglutinin" (WGA). Les structures roses correspondent aux arbuscules et aux hyphes colorées au WGA.
Figure 4: Racines de maïs colonisées par des arbuscules colorées au "wheat germ agglutinin" (WGA). Les structures roses correspondent aux arbuscules et aux hyphes colorées au WGA.B) Quels sont les consortiums microbiens capables de stimuler la nutrition azotée du maïs via les CMA et par quel mécanisme ? Cette recherche se penchera sur les mécanismes de recrutement du microbiote du maïs par les exsudats racinaires et sur la caractérisation des consortiums microbiens associés à la nutrition azotée des racines du maïs associée aux CMA. Pour répondre à ces questions, nous avons développé un système original de coculture maïs-CMA basé sur l'aéroponie (Figure 5) afin d'étudier quels métabolites sécrétés dans les exsudats racinaires des plantes peuvent jouer un rôle lors de la symbiose mycorhizienne (Decouard et al. 2025 JXB. in press).
 Figure 5: Système aéroponique de co-culture maïs-CMA. Ce dispositif permet l'étude de la composition métabolique des exsudats racinaires.
Figure 5: Système aéroponique de co-culture maïs-CMA. Ce dispositif permet l'étude de la composition métabolique des exsudats racinaires.Nous concentrons particulièrement nos recherches sur les bactéries rhizosphériques libres et endophytes fixatrices d'azote associées aux racines du maïs et à l'hyphosphère mycorhizienne. Ce travail est réalisé en trois étapes majeures : piégeage de bactéries et de champignons dans la rhizosphère (collab. J. Fievet, GQE), création de communautés synthétiques (SynCom), détermination des composés d'exsudats racinaires impliqués dans leur recrutement et optimisation de l'effet synergétique de la combinaison SynCom-CMA sur le métabolisme de l'azote du maïs. L'impact des consortiums bactériens et de l'AMF sur le métabolisme de l'azote du maïs sera caractérisé.
C) Quels sont les mécanismes impliqués dans la nutrition azotée dans les systèmes d'association légumineuses-céréales en présence de CMA et de symbiotes légumineuses fixateurs d'azote ? Les systèmes d'association représentent des stratégies agroécologiques clés pour optimiser et réduire l'utilisation d'engrais azotés de synthèse (Figure 7). Notre objectif est d'explorer l'effet bénéfique du réseau mycorhizien commun sur la redistribution de l'azote biologiquement fixé dérivé des légumineuses/rhizobiums vers les céréales, ainsi que d'explorer l'impact de la présence du couple légumineuses/rhizobiums sur les métabolismes primaire et secondaire du maïs dans un tel continuum d'interactions impliquant les CMA.
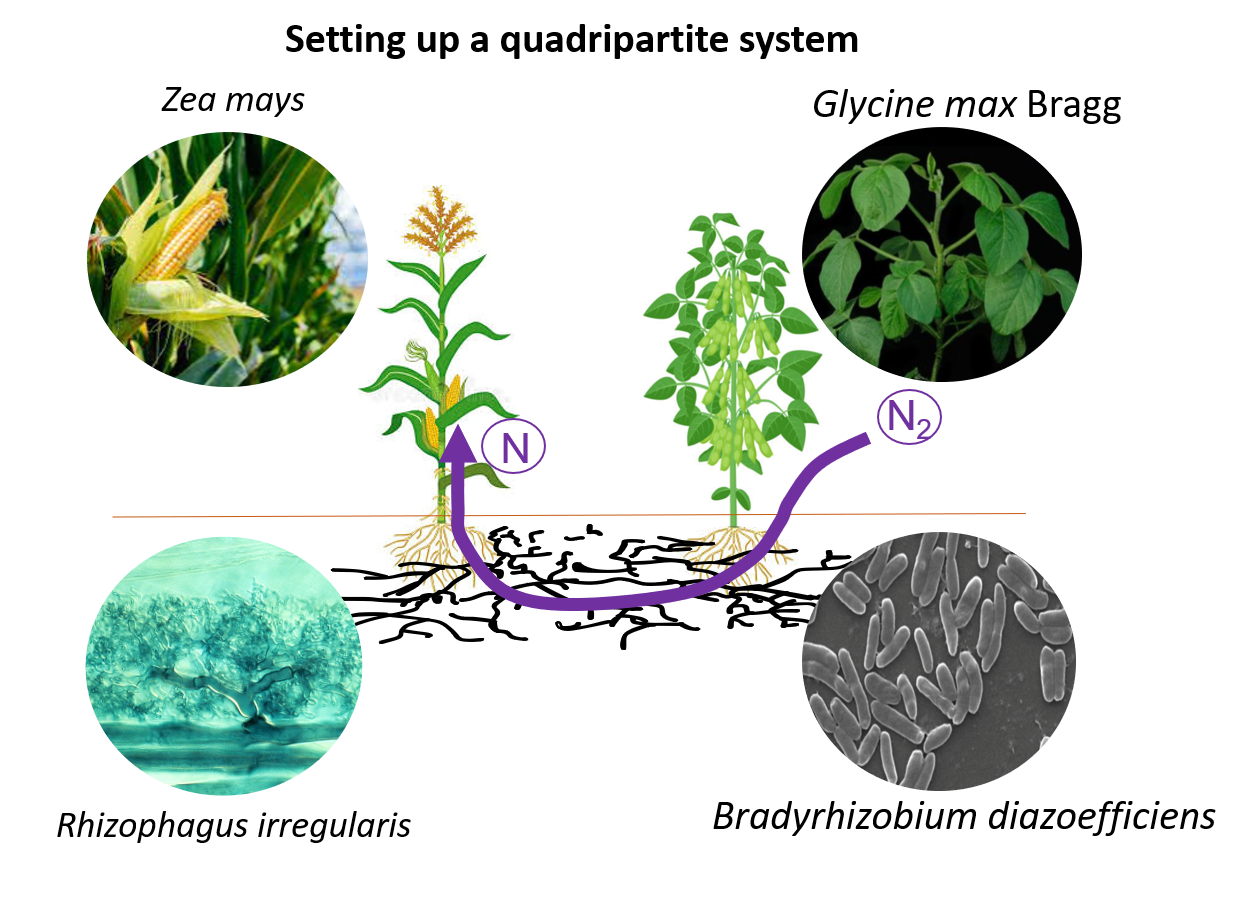
Figure 7: Système quadripartite maïs-CMA-soja-Bradyrhizobium pour les étudier les mécanismes liés au métabolisme de l'azote dans les systèmes de cultures associées.
Nous utiliserons la céréale maïs, la légumineuse soja, le champignon mycorhizien à arbuscules Rhizophagus irregularis et la souche bactérienne fixatrice d'azote Bradyrhizobium diazoefficiens en serre (Figure 8) et au champ. Le rôle du microbiome sur un tel système de culture associées sera étudié.
Modèles, outils et méthodes
Les principaux modèles biologiques sont le maïs, le sorgho, le soja pour le côté plante. Pour le côté microorganismes, nous utilisons le CMA R. irregularis, et la bactérie fixatrice d'azote Bradyrhizobium diazoefficiens. Des microorganismes isolés à partir de rhizosphères et hyphosphères restent à caractériser dans une collection. Plusieurs approches méthodologiques sont utilisées sur différents organes et à différentes échelles d'organisation de la plante et sur les partenaires microbiens.
Nous utilisons les approches suivantes :
-Physiologie, métabolisme et génétique moléculaire de la nutrition azotée.
-Microbiologie, écologie microbienne, culturomique.
-Métabarcoding, métagénomique.
-Phénotypage du niveau cellulaire (microscopie) à la plante entière en conditions contrôlées ou au champ.
-Biologie des systèmes, multi-omique (transcriptomique, métabolomique, protéomique).
-Modélisation métabolique.
Enjeux économiques et sociétaux
Les recherches menées par l'équipe SYNAPS visent à fournir des outils et des marqueurs permettant de sélectionner les plantes cultivées utilisant l'azote plus efficacement, réduisant ainsi l'utilisation excessive d'engrais azotés nocifs pour l'environnement. À ce titre, l'équipe SYNAPS participe à des projets innovants impliquant des partenaires industriels et des instituts techniques.
Publications récentes majeures (pour plus d'info cliquer):
Smith NT, Boukherissa A, Antaya K, Howe GW, Mergaert P, Rodríguez de la Vega RC, Shykoff JA, Alunni B, diCenzo GC (2025). Taxonomic distribution of SbmA/BacA and BacA-like antimicrobial peptide transporters suggests independent recruitment and convergent evolution in host-microbe interactions. Microb Genom, 11(4):001380. PubMed | DOI
Urrutia M, Blein-Nicolas M, Fernandez O, Bernillon S, Maucourt M, Deborde C, Balliau T, Rabier D, Benard C, Prigent S, Quilleré I, Jacob D, Gibon Y, Zivy M, Giauffret C, Hirel B, Moing A (2024). Identification of metabolic and protein markers representative of the impact of mild nitrogen deficit on agronomic performance of maize hybrids. Metabolomics, 20(6):128. PubMed | DOI
Chowdhury NB, Simons-Senftle M, Decouard B, Quilleré I, Rigault M, Sajeevan KA, Acharya B, Chowdhury R, Hirel B, Dellagi A, Maranas CD, Saha R (2023). A multi-organ maize metabolic model connects temperature stress with energy production and reducing power generation. iScience, 26(12):108400. PubMed | DOI
Terce Laforgue T, Lothier J, Limami AM, Rouster J, Lea PJ, Hirel B (2023). The Key Role of Glutamate Dehydrogenase 2 (GDH2) in the Control of Kernel Production in Maize (Zea mays L.). Plants, 12(14):2612. PubMed | DOILimami AM, Cukier C, Hirel B (2023). 15N-labelling of Leaves Combined with GC-MS Analysis as a Tool for Monitoring the Dynamics of Nitrogen Incorporation into Amino Acids. Methods Mol Biol, 2642:151-161. PubMed | DOI
Chowdhury NB, Schroeder WL, Sarkar D, Amiour N, Quilleré I, Hirel B, Maranas CD, Saha R (2022). Dissecting the metabolic reprogramming of maize root under nitrogen-deficient stress conditions. J Exp Bot, 73(1):275-291. PubMed | DOIValderrama-Martín JM, Ortigosa F, Ávila C, Cánovas FM, Hirel B, Cantón FR, Cañas RA (2022). A revised view on the evolution of glutamine synthetase isoenzymes in plants. Plant J. PubMed | DOI
Amiour N, Décousset L, Rouster J, Quenard N, Buet C, Dubreuil P, Quilleré I, Brulé L, Cukier C, Dinant S, Sallaud C, Dubois F, Limami AM, Lea PJ, Hirel B (2021). Impacts of environmental conditions, and allelic variation of cytosolic glutamine synthetase on maize hybrid kernel production. Commun Biol, 4(1):1095. PubMed | DOIDellagi A, Quilleré I, Hirel B (2020). Beneficial soil-borne bacteria and fungi: a promising way to improve plant nitrogen acquisition. J Exp Bot, . PubMed | DOI
Dellagi A, Quilleré I, Hirel B (2020). Beneficial soil-borne bacteria and fungi: a promising way to improve plant nitrogen acquisition. J Exp Bot, . PubMed | DOI
Livres :
-Philippe Reignault, Ivan Sache, Mathias Choquer, Marie-France Corio-Costet, Alia Dellagi, Frédéric Suffert Phytopathologie, (2023) ISBN-13 : 9782807302884.
-(Chapitre) Guellim, A, Hirel, B., Chabrerie, O., Catterou, M., Tetu, T., Dubois, F., Ben Ahmed, H., Kichey, T. (2021) Identification of Physiological Traits Associated with Salinity and Drought Tolerance in Wheat (Triticum durum Desf.).
-(Chapitre) Gorawala, P. and Mandhari, S. Eds. Agricultural Research Updates. Vol. 32, Agriculture, Imprints, Nova, Science and Technology Special Topics ISBN: 978-1-53618-974-2.
-(Chapitre) Limami, A.M., Cukier, C., Hirel, B., (2023)15N-labelling of Leaves Combined with GC-MS Analysis as a Tool for Monitoring the Dynamics of Nitrogen Incorporation into Amino. In: Couée, I. (eds) Plant Abiotic Stress Signaling. Methods in Molecular Biology, vol 2642. Humana, New York, NY.
Communication visible online :
Invitation by LIED (Laboratoire Interdisciplinaire des Energies de Demain). November 2023 : https://www.youtube.com/watch?v=9gzP28d6CD4 : Title « Microbe mediated plant N nutrition »
Invitation by SNHF-SNHF (Société Nationale d’Horticulture de France). November 2020: https://www.snhf.org/revoir-le-webinaire-3-sante-des-plantes-ressources-naturelles-et-biologie-contemporaine/

Responsable :
Alia DELLAGI