Le complexe TTP, un acteur majeur de la régulation spatiale du cytosquelette et de la géométrie cellulaire
Au cours de nos recherches, nous avons identifié un réseau de protéines, le complexe TTP, dont la fonction est de contrôler l'organisation spatiale des microtubules corticaux, tant pendant la croissance interphasique qu'à l'entrée en mitose pour la construction de l'anneau de préprophase (PPB).
Le PPB, un anneau cortical très dense composé de microtubules et de microfilaments d'actine, est une structure spécifique des plantes terrestres, qui contribue à la programmation pré-mitotique de la position du futur plan de division.
Le complexe TTP est une excellente porte d'entrée pour étudier les transitions du cytosquelette cortical, et explorer les circuits de régulation connectant ces transitions au cycle cellulaire.
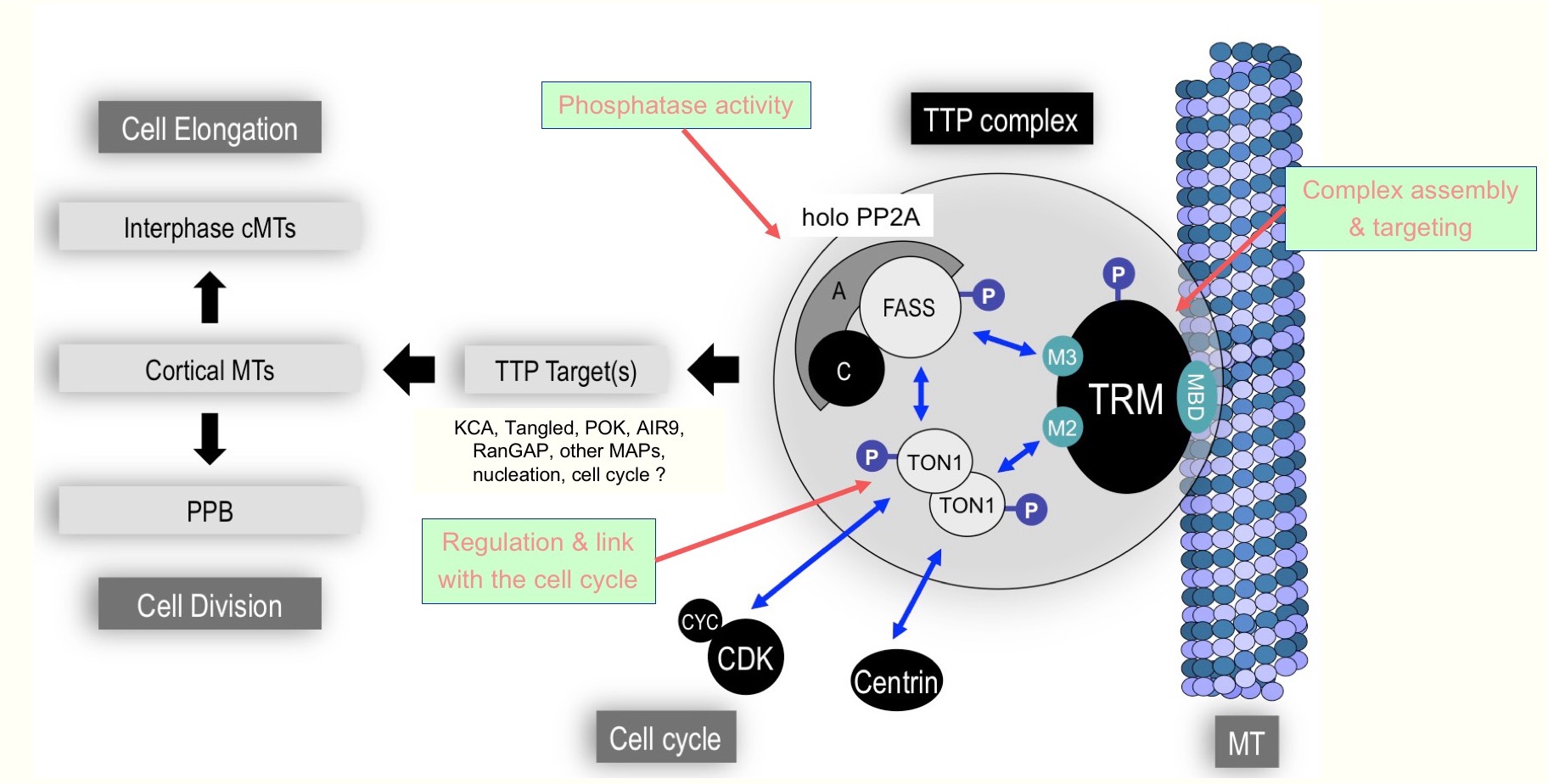
Au cours des dernières années, nous avons caractérisé les composants de ce complexe comme TON1 [1], FASS/PP2A [2, 3] ou TRM [4]. Globalement, une vision remarquablement cohérente émerge de ces études, qu'elles soient d'ordre cytologique, moléculaire, génétique ou biochimique.
Des mutations dans les "core-components" du complexe comme TON1, FASS ou certaines sous-unités PP2A conduisent à une absence de formation du PPB et une désorganisation complète des axes de division et de croissance chez Arabidopsis [1, 2, 3, 5] et la mousse Physcomitrella [6]. D'autre part, le complexe TTP participe à l'organisation du réseau cortical d'interphase, et les mutants TTP montrent de fortes perturbations dans les processus de croissance orientée. Le complexe TTP a donc des fonctions à la fois mitotiques et interphasiques. La composition, la localisation et l'activité des isoformes du complexes varient profondément au cours du cycle cellulaire [3]. Nos résultats suggèrent en effet une diversité fonctionnelle importante du complexe, en particulier en lien avec la diversité de la famille TRM (34 membres chez Arabidopsis) [4].
Au cours de nos recherches, nous avons identifié un réseau de protéines, le complexe TTP, dont la fonction est de contrôler l'organisation spatiale des microtubules corticaux, tant pendant la croissance interphasique qu'à l'entrée en mitose pour la construction de l'anneau de préprophase (PPB).
Le PPB, un anneau cortical très dense composé de microtubules et de microfilaments d'actine, est une structure spécifique des plantes terrestres, qui contribue à la programmation pré-mitotique de la position du futur plan de division.
Le complexe TTP est une excellente porte d'entrée pour étudier les transitions du cytosquelette cortical, et explorer les circuits de régulation connectant ces transitions au cycle cellulaire.

Au cours des dernières années, nous avons caractérisé les composants de ce complexe comme TON1 [1], FASS/PP2A [2, 3] ou TRM [4]. Globalement, une vision remarquablement cohérente émerge de ces études, qu'elles soient d'ordre cytologique, moléculaire, génétique ou biochimique.
Des mutations dans les "core-components" du complexe comme TON1, FASS ou certaines sous-unités PP2A conduisent à une absence de formation du PPB et une désorganisation complète des axes de division et de croissance chez Arabidopsis [1, 2, 3, 5] et la mousse Physcomitrella [6]. D'autre part, le complexe TTP participe à l'organisation du réseau cortical d'interphase, et les mutants TTP montrent de fortes perturbations dans les processus de croissance orientée. Le complexe TTP a donc des fonctions à la fois mitotiques et interphasiques. La composition, la localisation et l'activité des isoformes du complexes varient profondément au cours du cycle cellulaire [3]. Nos résultats suggèrent en effet une diversité fonctionnelle importante du complexe, en particulier en lien avec la diversité de la famille TRM (34 membres chez Arabidopsis) [4].
Réévaluation de la fonction du PPB et de l'importance de la géométrie des divisions chez les plantes terrestres
Dans le but de caractériser les formes du complexe TTP actives à l'entrée en mitose (transition G2/M), nous avons caractérisé en détail la famille TRM6-7-8.

Nous avons montré que TRM7 montre un profil d'expression, de localisation au PPB et de dégradation très spécifique au cours de la transition G2/M. La formation du PPB est complètement abolie dans un triple mutant trm678, nous donnant une occasion unique d'évaluer la fonction du PPB indépendamment de perturbations interphasiques [7]. Contrairement aux attentes, l'absence de PPB engendre des défauts morphologiques assez mineurs, avec une diminution du potentiel de croissance de la plante. De façon surprenante, l'absence de PPB n'abolit pas la formation du site cortical de division, mais induit une baisse de précision du positionnement du plan de division. Ces résultats nous ont conduit à redéfinir la fonction du PPB comme un filtre de débruitage plus que comme un déterminant majeur du site de division. De façon intéressante, les cellules dépourvues de PPB montrent des fuseaux de division mal positionnés, ce qui suggère que ce rôle de filtrage du PPB pourrait jouer sur le confinement des rotations du fuseau mitotique au cours de la prophase et de la métaphase.
Dans le but de caractériser les formes du complexe TTP actives à l'entrée en mitose (transition G2/M), nous avons caractérisé en détail la famille TRM6-7-8.

Nous avons montré que TRM7 montre un profil d'expression, de localisation au PPB et de dégradation très spécifique au cours de la transition G2/M. La formation du PPB est complètement abolie dans un triple mutant trm678, nous donnant une occasion unique d'évaluer la fonction du PPB indépendamment de perturbations interphasiques [7]. Contrairement aux attentes, l'absence de PPB engendre des défauts morphologiques assez mineurs, avec une diminution du potentiel de croissance de la plante. De façon surprenante, l'absence de PPB n'abolit pas la formation du site cortical de division, mais induit une baisse de précision du positionnement du plan de division. Ces résultats nous ont conduit à redéfinir la fonction du PPB comme un filtre de débruitage plus que comme un déterminant majeur du site de division. De façon intéressante, les cellules dépourvues de PPB montrent des fuseaux de division mal positionnés, ce qui suggère que ce rôle de filtrage du PPB pourrait jouer sur le confinement des rotations du fuseau mitotique au cours de la prophase et de la métaphase.
Mise en évidence d'un fort couplage division/élongation
Nos résultats, publiés ou en cours, sugèrent une grande variété d'isoformes du complexe TTP, avec des rôles spécialisés au cours du développement dans la division, la croissance ou la différenciation de types cellulaires spécifiques. De façon intéressante, nos études sur divers mutants du complexe révèlent que dans des cellules cyclantes, division et croissance sont étroitement couplées d'un point de vue spatial, à travers le co-alignement des réseaux de microtubule qui se succèdent durant le cycle cellulaire : les mutations affectant l'orientation de la division jouent aussi sur l'élongation, et vice-versa. C'est pourquoi division, élongation et différenciation cellulaires doivent être étudiées de façon conjointe. Pour caractériser ces connections, nous développons des outils de microfluidique, d'imagerie dynamique haute-résolution et d'analyse d'images.
Nos résultats, publiés ou en cours, sugèrent une grande variété d'isoformes du complexe TTP, avec des rôles spécialisés au cours du développement dans la division, la croissance ou la différenciation de types cellulaires spécifiques. De façon intéressante, nos études sur divers mutants du complexe révèlent que dans des cellules cyclantes, division et croissance sont étroitement couplées d'un point de vue spatial, à travers le co-alignement des réseaux de microtubule qui se succèdent durant le cycle cellulaire : les mutations affectant l'orientation de la division jouent aussi sur l'élongation, et vice-versa. C'est pourquoi division, élongation et différenciation cellulaires doivent être étudiées de façon conjointe. Pour caractériser ces connections, nous développons des outils de microfluidique, d'imagerie dynamique haute-résolution et d'analyse d'images.
Références
1. Azimzadeh et al. (2008). Plant Cell 20, 2146-2159
2. Camilleri et al. (2002). Plant Cell 14: 833-845
3. Spinner et al. (2013). Nature Com, 4:1863
4. Drevensek et al. (2012). Plant Cell 24: 178-191
5. Traas et al. (1995). Nature 375: 676-677
6. Spinner et al. (2010). Development, 137: 2733-2742
7. Schaefer et al. (2017). Science 356, 186–189
Responsable :
David Bouchez