La marge des feuilles comme modèle pour comprendre comment les frontières contrôlent la morphogenèse.
- Rôle des gènes CUC au cours du développement des feuilles.
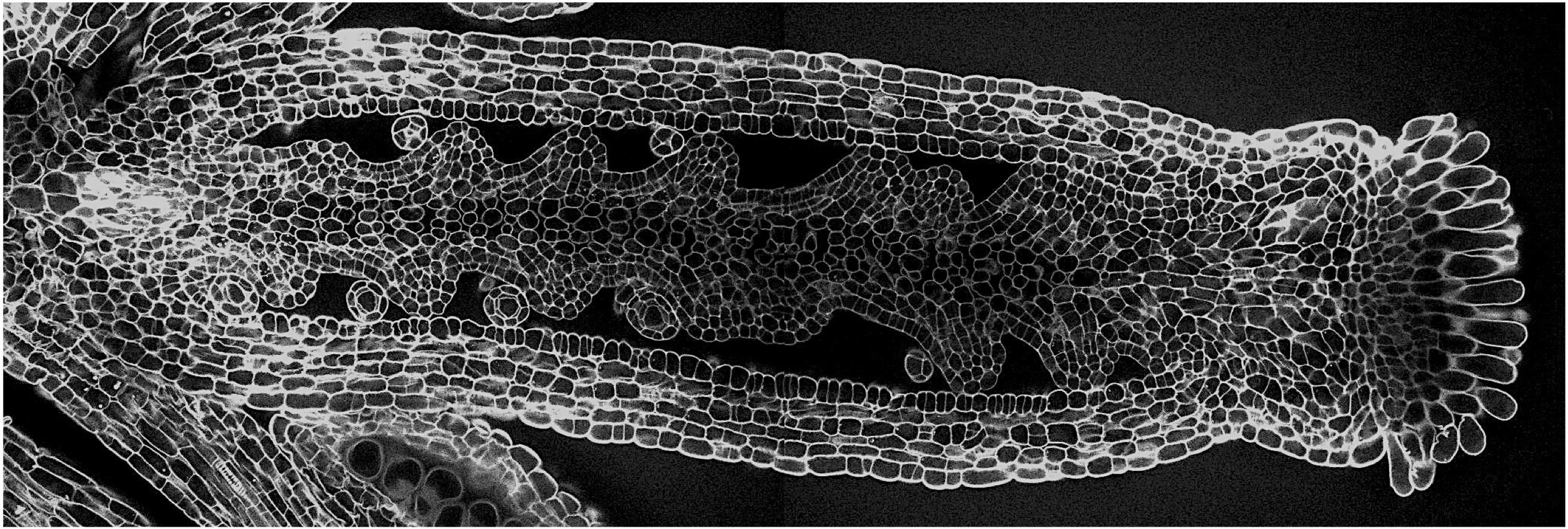
Nous avons montré que l’interaction entre le gène CUC2 et un microARN qui le cible (miR164 codé par le gène MIR164A) détermine le niveau de dissection de la marge foliaire d’Arabidopsis (Nikovics et al., 2006). Cette étude a révélé un nouveau rôle des gènes CUC dans un contexte différent de celui du méristème. Nous avons précisé la fonction des trois gènes CUC dans ce contexte, montrant que CUC1 n’a pas de rôle lors de la morphogenèse à la marge de feuille d’Arabidopsis thaliana. Au contraire, CUC2 est indispensable pour l’initiation des petites dentelures qui se trouvent sur la marge et CUC3 est nécessaire pour maintenir la croissance de ces dents (Hasson et al., 2011). Nous avons analysé le rôle des gènes CUC chez d’autres espèces qui présentent des feuilles composées formées de folioles comme la tomate (Blein et al., 2008). Chez ces espèces, les gènes CUC sont exprimés entre les petites folioles et sont non seulement nécessaires pour leur séparation mais aussi pour leur formation.
L’ensemble de ces travaux montrent que les gènes CUC jouent le rôle de “dissecteur universel” quelque soit le niveau de dissection de la marge foliaire.

- Rôle des gènes CUC au cours du développement des feuilles.
Nous avons montré que l’interaction entre le gène CUC2 et un microARN qui le cible (miR164 codé par le gène MIR164A) détermine le niveau de dissection de la marge foliaire d’Arabidopsis (Nikovics et al., 2006). Cette étude a révélé un nouveau rôle des gènes CUC dans un contexte différent de celui du méristème. Nous avons précisé la fonction des trois gènes CUC dans ce contexte, montrant que CUC1 n’a pas de rôle lors de la morphogenèse à la marge de feuille d’Arabidopsis thaliana. Au contraire, CUC2 est indispensable pour l’initiation des petites dentelures qui se trouvent sur la marge et CUC3 est nécessaire pour maintenir la croissance de ces dents (Hasson et al., 2011). Nous avons analysé le rôle des gènes CUC chez d’autres espèces qui présentent des feuilles composées formées de folioles comme la tomate (Blein et al., 2008). Chez ces espèces, les gènes CUC sont exprimés entre les petites folioles et sont non seulement nécessaires pour leur séparation mais aussi pour leur formation.
L’ensemble de ces travaux montrent que les gènes CUC jouent le rôle de “dissecteur universel” quelque soit le niveau de dissection de la marge foliaire.

- Exploration des voies par lesquelles CUC2 contrôle la morphogenèse foliaire
Afin d’identifier des intermédiaires de l’action de CUC2 sur le développement foliaire, nous avons réalisé un crible de suppresseurs génétiques du phénotype hyper dentelé de plantes surexprimant CUC2.
Ainsi, nous avons identifié et caractérisé un mutant dans le gène MURUS1 (MUR1), un gène codant une enzyme produisant le GDP-L-fucose. Une analyse morphométrique fine a permis de montrer que le GDP-L-fucose est indispensable pour une mise en place d’une morphologie foliaire normale, probablement en partie via l’activation de l’expression de CUC2 (Goncalves et al., 2017). Le mécanisme d'action du fucose sur l'expression du gène CUC2 n'est pas connu mais nous avons déterminé qu'il n'impliquait pas une fucosylation des xyloglucanes (Goncalves et al., 2018).
Nous avons identifié un réseau génétique et moléculaire agissant en aval de CUC2 lors de la morphogenèse foliaire et qui assure la coordination spatiale des tissus et de la croissance (Maugarny-Calès et al., 2019). A l'échelle cellulaire, CUC2 inhibe l'expression de gènes qui contrôlent l'expansion des parois permettant ainsi de rigidifier les parois des cellules qui constituent les domaines frontières à la marge des feuilles (Bouré et al, 2022).

Afin d’identifier des intermédiaires de l’action de CUC2 sur le développement foliaire, nous avons réalisé un crible de suppresseurs génétiques du phénotype hyper dentelé de plantes surexprimant CUC2.
Ainsi, nous avons identifié et caractérisé un mutant dans le gène MURUS1 (MUR1), un gène codant une enzyme produisant le GDP-L-fucose. Une analyse morphométrique fine a permis de montrer que le GDP-L-fucose est indispensable pour une mise en place d’une morphologie foliaire normale, probablement en partie via l’activation de l’expression de CUC2 (Goncalves et al., 2017). Le mécanisme d'action du fucose sur l'expression du gène CUC2 n'est pas connu mais nous avons déterminé qu'il n'impliquait pas une fucosylation des xyloglucanes (Goncalves et al., 2018).
Nous avons identifié un réseau génétique et moléculaire agissant en aval de CUC2 lors de la morphogenèse foliaire et qui assure la coordination spatiale des tissus et de la croissance (Maugarny-Calès et al., 2019). A l'échelle cellulaire, CUC2 inhibe l'expression de gènes qui contrôlent l'expansion des parois permettant ainsi de rigidifier les parois des cellules qui constituent les domaines frontières à la marge des feuilles (Bouré et al, 2022).

Elargir le rôle connu des domaines frontières du méristème à d’autres organes durant le développement des plantes.
La connaissance du rôle des frontières au cours du développement des plantes s'est améliorée lors de la dernière décennie, et notre groupe y a contribué en analysant leur fonction pendant le développement des feuilles, la formation des méristèmes axillaires, l'architecture des inflorescences, et la chute des feuilles. Nous avons enrichi cette connaissance en révélant un rôle conservé au cours de l'évolution des gènes CUC dans la séparation des ovules chez des espèces caractérisées par des architectures distinctes du gynécée (Goncalves et al., 2015).
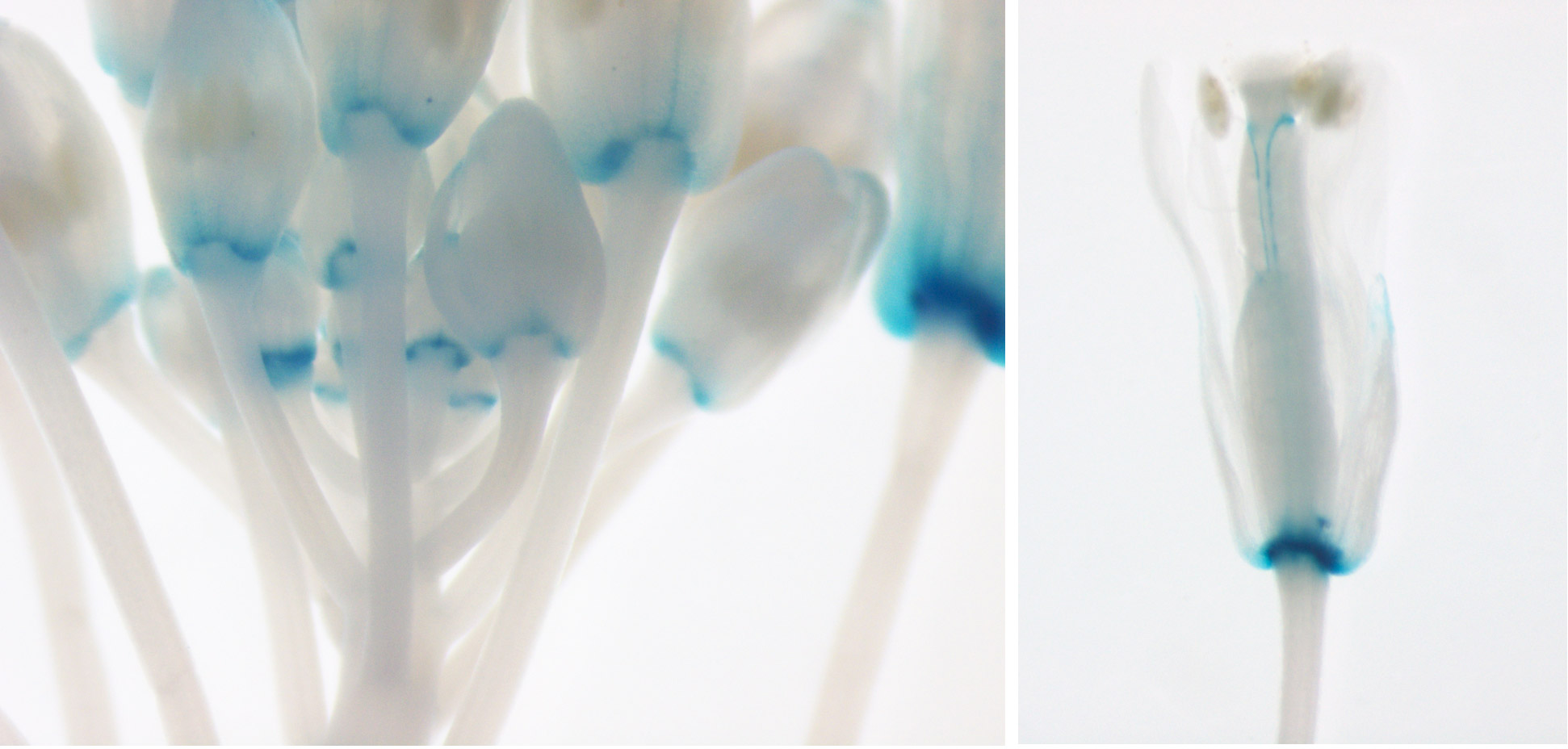
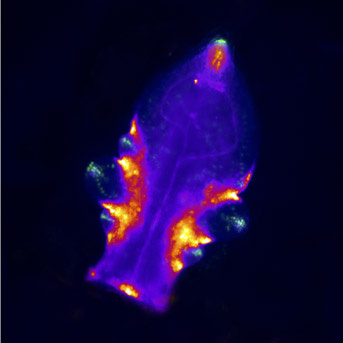
L'initiation des méristèmes axillaires dépend également des gènes CUC. Nous avons montré que les facteurs de transcription NGATHA-like répriment l'expression des CUC dans le centre du méristème pour faciliter la formation d'une nouvelle population de cellules souches (Nicolas et al., 2022).

L'initiation des méristèmes axillaires dépend également des gènes CUC. Nous avons montré que les facteurs de transcription NGATHA-like répriment l'expression des CUC dans le centre du méristème pour faciliter la formation d'une nouvelle population de cellules souches (Nicolas et al., 2022).

Les facteurs de transcription à homédomaine de la famille TALE constituent des régulateurs majeurs de l'activité des méristèmes et des domaines frontières (Hepworth et Pautot 2015). Nous avons montré chez Arabidopsis que KNAT6 contribue au maintien du méristème et des frontières (Belles-Boix et al. 2006) et qu'une interaction antagoniste entre les différents membres de la famille TALE gouverne le maintien des frontières dans les inflorescences (Ragni et al. 2008). En collaboration avec le laboratoire de Shelley Hepworth (Carleton University, Ottawa Canada), nous avons démontré que les co-activateurs BLADE ON PETIOLE (BOP) forment avec les facteurs de transcriptions KNAT6, ATH1, KNAT2 un module pour maintenir les frontières (Khan et al., 2015). Actuellement, nous étudions le rôle de ce module dans deux processus liés qui dépendent de l'activité des domaines frontières : la chute des organes floraux, l'abscission et l'ouverture des fruits, la déhiscence.

Responsable :
Patrick Laufs