Dans tous les organismes, les lipides de réserve sont maintenus dans le cytoplasme dans des organites spécialisés appelés corps lipidiques (CL). Ces nanoparticules sont constituées essentiellement d'un cœur de lipides neutres (triglycérides et/ou esters de stérols) entouré par une monocouche de phospholipides qui contient un nombre variable de protéines. Plus qu'une boule de gras inerte, les CL sont des organites complexes et des défauts dans leur dynamique provoque de nombreuses maladies (stéatose hépatique, diabète, myopathies, …).
Dans le contexte de la chimie verte, les CL sont une source prometteuse de dérivés lipidiques pour l'alimentation, la chimie, la médecine et la cosmétique. Pour ces raisons, une meilleure connaissance de la structure et du "cycle de vie" des CLs est d'importance majeure.
Dans le contexte de la chimie verte, les CL sont une source prometteuse de dérivés lipidiques pour l'alimentation, la chimie, la médecine et la cosmétique. Pour ces raisons, une meilleure connaissance de la structure et du "cycle de vie" des CLs est d'importance majeure.
Etude des protéines intégrales de classe I du corps lipidique.
Nous sommes spécialisés dans l’étude structurale et fonctionnelle des protéines intégrale du CL (protéine de classe I du CL) insérées dans leur contexte natif. Actuellement, nous étudions la convergence évolutive de ces protéines dans différents règnes du vivant. En effet, de nombreuses protéines associées à la surface des CL ne présentent pas de conservation de séquence primaire de leurs acides aminés mais une convergence structurale avec un repliement de type épingle à cheveux ou "hairpin". Ce repliement particulier permet un ancrage fort de ces protéines au sein de la monocouche de phospholipides et un contact avec le cœur de lipides neutres des CL.
Très peu de données structurales existent sur ces protéines car elles sont très difficiles à manipuler en raison de leur forte hydrophobicité et aucune étude sur cette convergence structurale n'existe à l'heure actuelle. Nous avons développé un système cellulaire modèle basé sur l'expression hétérologue de ces protéines du CL de classe I dans un eucaryote modèle, Saccharomyces cerevisiae (Purkrtova, 2015, Vindigni et al 2013, Jamme et al. 2013). Cet outil nous a permis d'effectuer plusieurs études fonctionnelles et structurales des protéines du CL de classe I des CL de graines.
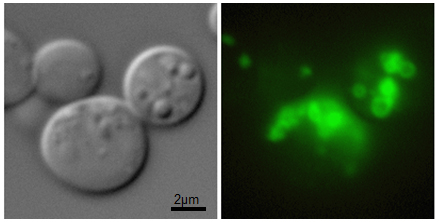
Actuellement nous nous intéressons à d'autres protéines de classe I du CL dont la cavéoline et la protéine core du virus de l'hépatite C (VHC). La protéine core du VHC s'associe aux CL au cours de l'infection et participe à l'accumulation de CL dans les cellules du foie aboutissant à une stéatose qui peut évoluer en cirrhose ou cancer. La compréhension des mécanismes d'adressage et d'ancrage de la protéine core, ainsi que son impact sur le métabolisme des lipides et des CL dans la cellule, peut permettre d'ouvrir des pistes pour le développement de traitements contre l'infection du VHC ou d'autres virus détournant les CL pour leur cycle viral.
Nous sommes spécialisés dans l’étude structurale et fonctionnelle des protéines intégrale du CL (protéine de classe I du CL) insérées dans leur contexte natif. Actuellement, nous étudions la convergence évolutive de ces protéines dans différents règnes du vivant. En effet, de nombreuses protéines associées à la surface des CL ne présentent pas de conservation de séquence primaire de leurs acides aminés mais une convergence structurale avec un repliement de type épingle à cheveux ou "hairpin". Ce repliement particulier permet un ancrage fort de ces protéines au sein de la monocouche de phospholipides et un contact avec le cœur de lipides neutres des CL.
Très peu de données structurales existent sur ces protéines car elles sont très difficiles à manipuler en raison de leur forte hydrophobicité et aucune étude sur cette convergence structurale n'existe à l'heure actuelle. Nous avons développé un système cellulaire modèle basé sur l'expression hétérologue de ces protéines du CL de classe I dans un eucaryote modèle, Saccharomyces cerevisiae (Purkrtova, 2015, Vindigni et al 2013, Jamme et al. 2013). Cet outil nous a permis d'effectuer plusieurs études fonctionnelles et structurales des protéines du CL de classe I des CL de graines.

Actuellement nous nous intéressons à d'autres protéines de classe I du CL dont la cavéoline et la protéine core du virus de l'hépatite C (VHC). La protéine core du VHC s'associe aux CL au cours de l'infection et participe à l'accumulation de CL dans les cellules du foie aboutissant à une stéatose qui peut évoluer en cirrhose ou cancer. La compréhension des mécanismes d'adressage et d'ancrage de la protéine core, ainsi que son impact sur le métabolisme des lipides et des CL dans la cellule, peut permettre d'ouvrir des pistes pour le développement de traitements contre l'infection du VHC ou d'autres virus détournant les CL pour leur cycle viral.
Ce travail est effectué en collaboration avec Y.Gohon (INRAE) et bénéficie du soutien de l'ANRS (CI19044)
Etude structurale des corps lipidiques in cellulo par imagerie synchrotron sans marquage
Le cœur des corps lipidique est constitué essentiellement de lipides neutres, triglycérides et/ou esters de sterols. La structuration de ces lipides dans le cœur est encore en débat. Des scientifiques ont observé une ségrégation de ces lipides du cœur des CL mais il a été suggéré par d'autres que cela pouvait être un artefact lié à la purification ou la fixation chimique des CL. Il apparait donc essentiel de pouvoir imager les CL dans leur état natif et dans un environnement cellulaire inaltéré. Nous avons développé des techniques d'imagerie pour l'étude ultrastructurale des corps lipidiques natifs in cellulo.
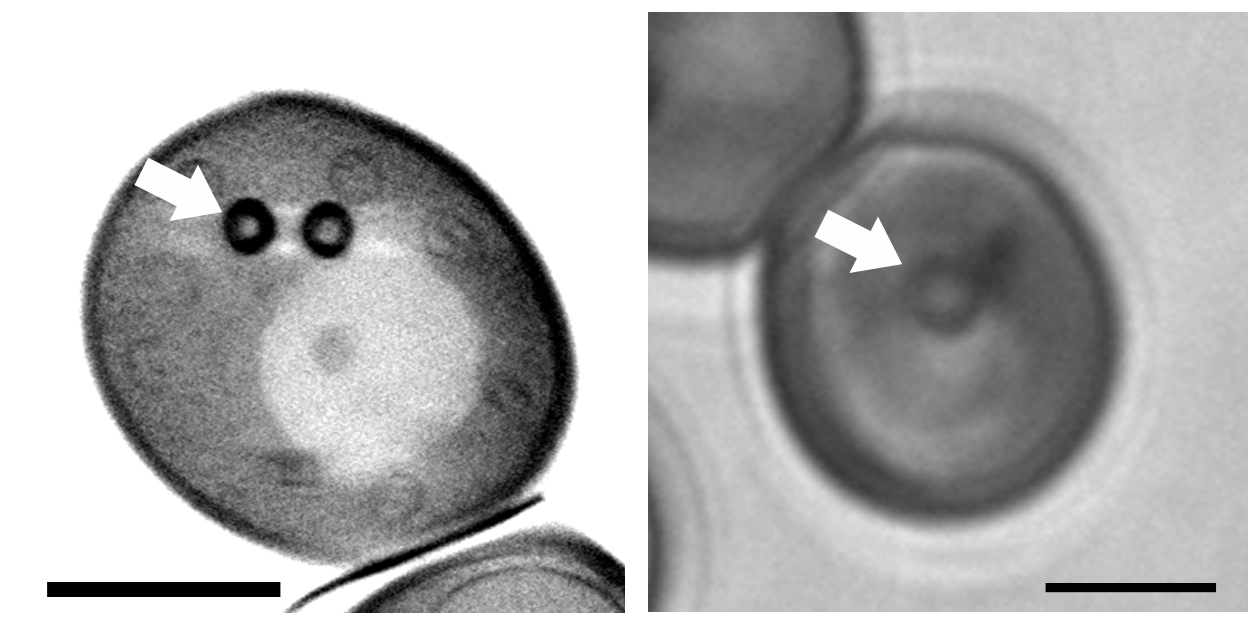 Grâce à des techniques sans marquage utilisant le rayonnement synchrotron, la tomographie x mous et la transmittance UV lointains, nous avons montré que les CL sont des structures organisées, avec une ségrégation des esters de stérol à la périphérie du cœur des CL (Jamme et al. sous presse). L'utilisation de l'imagerie multimodales UV lointains, transmittance et tryptophane/tyrosine autofluorescence, permet également d'obtenir des informations sur le contenu chimique à l'échelle subcellulaire. Ces approches multimodales ouvrent la voie au développement de nouvelles techniques d'imagerie des organites sans marquage.
Grâce à des techniques sans marquage utilisant le rayonnement synchrotron, la tomographie x mous et la transmittance UV lointains, nous avons montré que les CL sont des structures organisées, avec une ségrégation des esters de stérol à la périphérie du cœur des CL (Jamme et al. sous presse). L'utilisation de l'imagerie multimodales UV lointains, transmittance et tryptophane/tyrosine autofluorescence, permet également d'obtenir des informations sur le contenu chimique à l'échelle subcellulaire. Ces approches multimodales ouvrent la voie au développement de nouvelles techniques d'imagerie des organites sans marquage.Ce travail est effectué en collaboration avec F. Jamme, M. Réfrégiers (synchrotron SOLEIL), B. Cinquin (IPGG), E. Pereiro (synchrotron ALBA), Y. Gohon (INRAE) et a bénéficié du soutien financier du synchrotron SOLEIL (subventions 20140219; 20141082; 20150869) et du synchrotron ALBA (subvention 2015021150).
Biodiversité de la production des lipides chez les Saccharomycotina
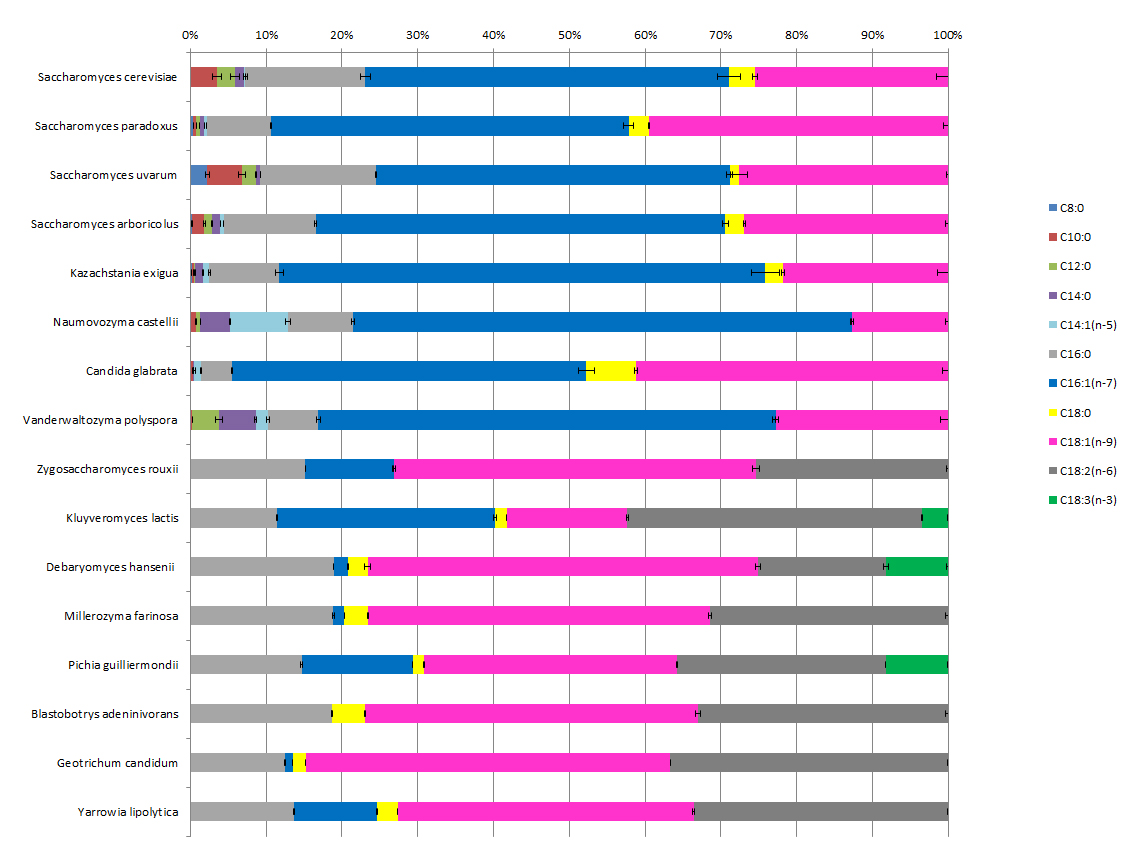
L'exploitation de la ressource génétique du vivant est une des approches envisagée pour répondre aux besoins des filières chimie verte et nutrition-santé pour la production de lipides vers des molécules "à façon" répondant à des contraintes d'usage. Des analyses exploratoires de la teneur en acides gras effectuées sur différentes espèces de levures ont révélé la présence de profils très contrastés entre les souches.
 Nous avons pu montrer que
Nous avons pu montrer que-
Les acides d’acides gras moyens sont présents dans un nombre très restreint d’espèces (dites post-WGD, dont l’ancêtre a subi la duplication du génome). Ce travail fait l'objet d'une publication (Froissard, et al. 2015).
-
De très fortes teneurs en acides gras polyinsaturés (AGPI) sont présentes dans certains isolats géographiques d’espèces du genre Debaryomyces. Une analyse bioinformatique de la présence de certains gènes dans les levures dont le génome est séquencé indique une distribution atypique en accord avec les observations sur la production d'AGPI.
Actuellement nous nous focalisons sur la teneur en omega 3 de certaines souches et étudions la relation possible entre,
- Teneur en omega 3 -physiologie des cellules (morphologie, fluidité des membranes, …)
- origine géographique des souches -diversité des allèles du gène FAD3 responsable de la désaturation de l'omega6 en omega3,
- régulation de ces gènes.
